“Anodo” e “catodo” sono termini fondamentali usati nell’elettrochimica e nei circuiti elettronici. Questi due tipi di elettrodi svolgono un ruolo importante in una varietà di sistemi, dalle semplici batterie alle tecnologie avanzate.
Esaminiamo le loro differenze, le etichette positive e negative e come puoi facilmente sapere quale è negativa o positiva.
Sommario:
Cos’è un elettrodo?
È importante comprendere l’idea generale di cosa sia realmente un elettrodo prima di addentrarsi nella complessità di cosa sia un catodo o un anodo. Nel senso più elementare, un elettrodo è un materiale che aiuta nella conduzione dell’elettricità, consentendo alla corrente elettrica di entrare o uscire da un mezzo non metallico, come una cella elettrolitica.
In poche parole, un elettrodo funge da conduttore per stabilire un contatto elettrico con un componente non metallico del circuito.
Cos’è un anodo?

La polarità di un elettrodo, sia esso un anodo o un catodo, dipende dal tipo di circuito. L’anodo è l’elettrodo in cui si verifica l’ossidazione, con conseguente perdita di elettroni. Guardando cosa succede in una cella galvanica (che converte l’energia chimica in elettrica, come una batteria che si scarica), l’anodo funge da elettrodo negativo poiché, durante l’ossidazione, gli elettroni vengono lasciati sull’elettrodo e fluiscono attraverso il circuito esterno.
Al contrario, nell’elettrolisi, dove una corrente elettrica guida il flusso di elettroni nella direzione opposta, l’anodo diventa l’elettrodo positivo.
Cos’è un catodo?
 Credito immagine: Lampone Pi
Credito immagine: Lampone Pi
Il catodo funge da sito in cui si verifica la riduzione, facilitando l’acquisizione di elettroni. In una cella galvanica, agisce come l’elettrodo positivo poiché gli ioni subiscono una riduzione acquisendo elettroni dall’elettrodo e successivamente si placcano.
D’altra parte, nell’elettrolisi, il catodo è il terminale negativo, attirando ioni positivi dalla soluzione.
Anodo contro catodo: chiarire la polarità
Inizialmente si credeva che l’elettricità fluisse dal positivo al negativo, l’opposto di ciò che ora capiamo essere vero. Questo malinteso iniziale ha portato alcuni ad associare l’anodo alla negatività e il catodo alla positività.
Tuttavia, con la corretta comprensione dei ruoli dell’ossidazione e della riduzione in ciascun elettrodo, diventa facile identificare quale sia l’anodo o il catodo, questo dipende dal tipo di circuito.
Cos’è un elettrolita in una batteria?
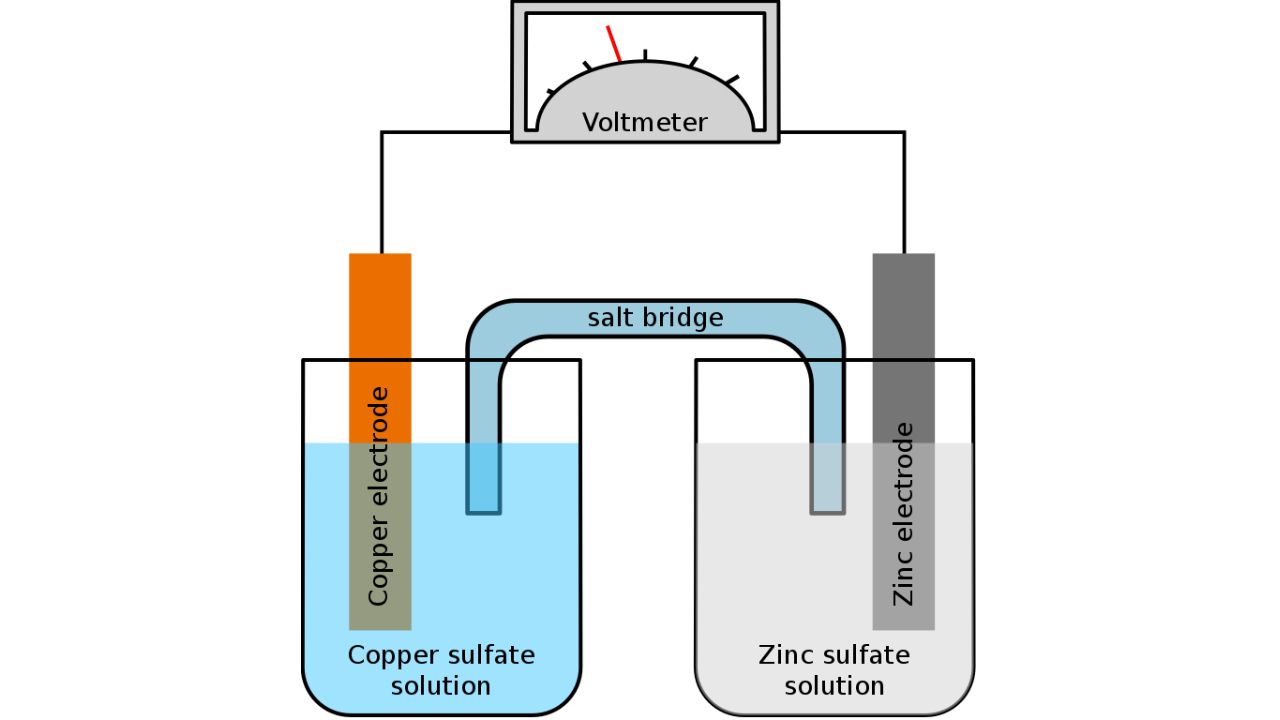 Immagine di credito: Tinux/gringer/Wikimedia Commons
Immagine di credito: Tinux/gringer/Wikimedia Commons
Nelle batterie, l’elettrolita si riferisce al mezzo che consente il flusso di ioni tra l’anodo e il catodo mantenendoli elettricamente neutri. Questo movimento ionico è essenziale per le reazioni chimiche che si verificano durante i processi di carica e scarica. Per saperne di più, leggi come funzionano le batterie EV agli ioni di litio.
Quale è positivo?
Per comprendere le polarità quando si parla di elettrodi in una cella o in un circuito, è importante considerare le due reazioni che avvengono nei due siti. In una cella galvanica, l’anodo subisce ossidazione e funge da elettrodo negativo, mentre nell’elettrolisi diventa l’elettrodo positivo. Al contrario, il catodo facilita la riduzione e funge da elettrodo positivo in una cella galvanica ma funge da terminale negativo nell’elettrolisi.